Degradación ruminal en bovinos de la proteína cruda de la paja amarilla (Sorghastrum setosum) a diferentes edades de rebrote y estaciones del año
Resumen
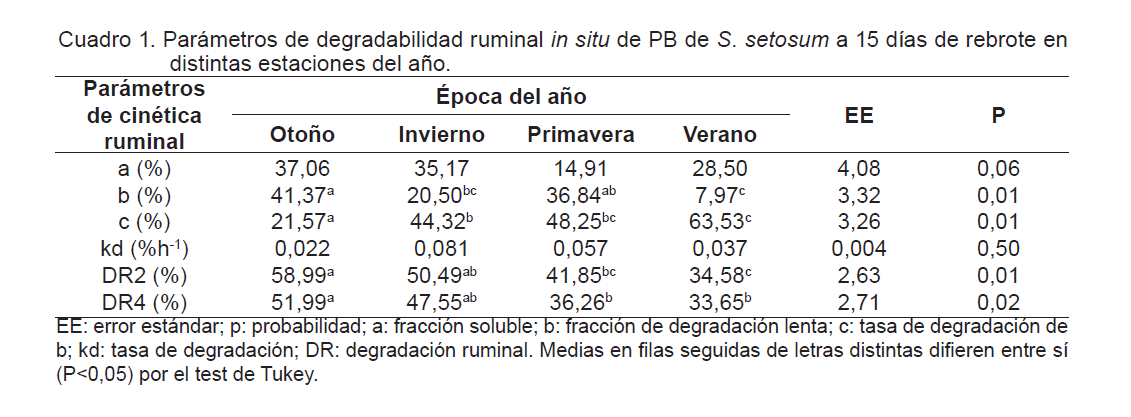
Con el objetivo de evaluar la degradación en rumen de bovinos de la proteína cruda (PC) de Sorghastrum setosum (paja amarilla) en distintas épocas del año, se recolectaron muestras a 5 cm de altura, correspondientes a los 15, 30 y 45 días de rebrote, y se utilizó la técnica de suspensión in situ de bolsas de dacrón en el rumen de novillos cruza cebú de 550 kg de peso vivo, provistos de fístula ruminal, las bolsas fueron incubadas durante 0, 3, 6, 12, 24, 48, 72 y 120 horas. Los datos se ajustaron con el modelo propuesto por Ørskov y McDonald (1979). Los pará- metros de la curva de degradación y la degradabilidad efectiva fueron analizados mediante el procedimiento GLM del paquete estadístico SAS. Los resultados obtenidos de la degradabilidad ruminal de la PC para el rebrote de 15 y 45 días, muestran que la fracción soluble (a) tuvo una tendencia a ser diferente entre las diferentes estaciones (P = 0,06 y 0,08) respectivamente, no así el rebrote de 30 días. La fracción potencialmente degradable (b) y su tasa de degradación (c) solo fue diferente para el rebrote de 15 días (P<0,01), la degradabilidad ruminal efectiva (DR) solo se diferenció (P<0,05) en el corte de 15 días. No se encontraron diferencias en los demás parámetros de la cinética, esto sugiere que la técnica utilizada no fue sensible para diferenciar el efecto de los tiempos de rebrote y las estaciones del año.
Descargas
Citas
• Arias Usandivaras, LM. 2006. Controles climáticos de la productividad primaria de pastizales de la Provincia de Corrientes. Trabajo correspondiente al ciclo de intensificación para acceder al grado de Ingeniero Agrónomo. Universidad de Buenos Aires, Facultad de Agronomía.
• Arthington, JD; Brown,WF. 2005. Estimation of feeding value of four tropical forage species at two stages of maturity. Journal of Animal Science 83:1726–1731.
• Barahona, R; Sánchez, S. 2005. Limitaciones físicas y químicas de la digestibilidad de pastos tropicales y estrategias para aumentarla. Revista Corpoica 6(1):69–82.
• Barrera Álvarez, A; Avellaneda Cevallos, JH; Tapia Moreno, EO; Peña Galeas, MM; Molina Hidrovo, CA; Casanova Ferrein, LM. 2015. Composición química y degradación de cuatro especies de Pennisetum sp. Ciencia y Tecnología 8(2):13–27.
• Bernal, L; Ávila, P; Ramírez, G; Lascano, CE. 2008. Efecto de la suplementación con heno de Calliandra calothyrsus y Vigna unguiculata sobre la producción de leche para vacas Holstein x cebú en Colombia. Archivos latinoamericanos de producción animal 16(3):109–114.
• Bolívar Vergara, DM; Ibrahim, M. 2001. Solubilidad de la proteína y degradabilidad ruminal de Brachiaria humidicola en un sistema silvopastoril. Congreso Latinoamericano sobre Agroforestería para la Producción Agrícola Sostenible (1, 1999, Cali, Colombia). Cali, Colombia, 18 p.
• Caro-Costa, R; Abruña, F; Figarella, J. 1978. Effect nitrogen rates, harvest interval and cutting height on yield and composition of Star grass in Puerto Rico. Journal of Agriculture of the University of Puerto Rico 56(3):267–279.
• Chacon Hernández, PA; Vargas Rodríguez, CF. 2009. Digestibilidad y calidad del Pennisetum purpureum cv. King grass a tres edades de rebrote. Agronomía Mesoamericana 20(2):399–408.
• Cuartas, C; Naranjo, J; Tarazona, A; Murgueitio, E; Chará, J; Ku Vera, J. 2014. Contribution of intensive silvopastoral systems to animal performance and to adaptation and mitigation of climate change. Revista Colombiana de Ciencia Pecuaria 27(2):76-94.
• Del Pozo, PP; Herrera, RS; Blanco, F. 2011. Bases ecofisiológicas del manejo de los pastos. In Milera Rodríguez, MDLC (ed.). André Voisin. Experiencia y aplicación de su obra en Cuba. La Habana, Cuba. Editorial Universitaria. p. 371-397.
• Devendra, C. 1995. Composition and nutritive value of browse legumes. In D’Mello, J.; Devendra, C. (eds.). Tropical Animal Nutrition. London, United Kingdom. CAB International. p 49–66.
• Evangelista, AR; Junqueira De Sales, EC; Teixeira, JC; Porto Rocha, G; Fonseca De Freitas, RT. 2002. Degradabilidade ruminal da materia seca e proteína bruta de cultivares de alfafa (Medicago sativa L.) Ciência e Agrotecnologia 26(6)1281-1288.
• Gates, RN; Mislevy, P; Martín, FG. 2001. Herbage accumulation of Three Bahiagrass populations during the cool season. Agronomy Journal 93(1):112–117.
• Higgs, RJ; Sheaham, AJ; Mandok, K; Van Amburg, ME; Roche, JR. 2013. The effect of starch, fiber, or sugar based supplements on nitrogen utilization in grazing dairy cows. Journal of Dairy Science 96(6):3857-3866.
• Juárez-Hernández, J; Bolaños-Aguilar, ED. 2007. Las curvas de dilución de la proteína como alternativa para la evaluación de pastos tropicales. Universidad y Ciencia 23(1):81–90.
• Lara Mantilla, C; Oviedo Zumaqué, LE; Betancur Hurtado, CA. 2010. Efecto de la época de corte sobre la composición química y degradabilidad ruminal del pasto Dichantium aristatum (Angleton). Zootecnia Tropical 28(2):275–281.
• Lemaire, G; Agnusdei, M. 2000. Leaf tissue turnover and efficiency of herbage utilisation. In Lemaire, G; Hodgson, J; Moraes, H; Nabinger, C; Carvalho, PCE. (eds.). Grassland Ecophysiology and Grazing Ecology. Wallingford, United Kingdom. CABI Publishing. p. 265–267.
• Maldonado, G; Velásquez, JE. 1994. Determinación de la capacidad de carga y la ganancia de peso de bovinos en pastoreo de gramíneas del piedemonte amazónico de Colombia. Pasturas Tropicales 16(2):2–8.
• Márquez, F; Sánchez, J; Urbano, D; Dávila, C. 2007. Evaluación de la frecuencia de corte y tipos de fertilización sobre genotipos de pasto Elefante (Pennisetum purpureum). 1. Rendimiento y contenido de proteína. Zootecnia Tropical 25(4):253–259.
• Méndez-Cruz, A. 1981. Evaluación nutritiva de gramíneas forrajeras tropicales. ALPA. Memorias 16: 90.
• Merkl, N; Schultze-Kraft, R; Arias, M. 2006. Effect of the tropical grass Brachiaria bizantha (Hochst. Ex Rich.) Stapf on microbial population and activity in petroleoum-contaminated soil. Microbiological Research 161:80-91.
• Michalet-Doreau, B; Ould-Bah, MY. 1992. Influence of hay making on in situ nitrogen degradability of forages in cows. Journal of Dairy Science 75:782.
• Minson, DJ; Milford, R. 1967. The voluntary intake and digestibility of diets containing different proportions of legume and mature Pangola Grass (Digitaria decumbens). Australian Journal of Experimental Agriculture and Animal Husbandry 7(29):546 –551.
• Naranjo, JF; Cuartas, CA. 2011. Nutritional characterization and ruminal degradation kinetics of some forages with potential for ruminants supplementation in the highland tropics of Colombia. Revista CES Medicina Veterinaria y Zootecnia 6(1):9-19.
• Nolan, JV; Dobos, RC. 2005. Nitrogen Transactions in Ruminants. In Dijkstra, J; Forbes, JM; France, J. (eds.). Quantitative Aspects of Ruminant Digestion and Metabolism. 2 ed. Wallingford, United Kingdom. CABI Publishing. p.177–207.
• Olaisen, V; Mejdell, T; Volden, H; Nesse, N. 2003. Simplified in situ method for estimating ruminal dry matter and protein degradability of concentrates. Journal of Animal Science 81:520–528.
• Ørskov, ER. 1988. Nutrición Proteica de los Animales. Zaragoza, España, Editorial Acribia. 178 p.
• Ørskov, ER; McDonald, I. 1979. The estimation of protein degradability in the rumen from incubation measurements weighted according to rate of passage. Journal of Agricultural Science 92,499-503.
• Ørskov, ER; Hovell, FD; Mould, F. 1980. the use of the nylon bag technique for the evaluation of feedstuffs. Tropical Animal Production 5(3):195-213.
• Ortega-Gómez, R; Castillo-Gallegos, E; Jarillo-Rodríguez, J; Escobar-Hernández, R; Ocaña-Zavaleta, E; Valles de la Mora, B. 2011. Nutritive quality of ten grasses during the rainy season in a hot-humid climate and ultisol soil. Tropical and Subtropical Agroecosystems 13: 481-491.
• Patiño Ospina, H. 2010. Optimización de la suplementación proteica de ganado de carne en pasturas de baja calidad (en línea). Consultado 22 oct. 2016. Disponible en http://bit.ly/2tnnoQv
• Pérez, JA; García, E; Enríquez, JF; Quero, AR; Pérez, J; Hernández, A. 2004. Análisis de crecimiento, área foliar específica y concentración de nitrógeno en hojas de pasto “mulato” (Brachiaria hibrido, cv.). Técnica Pecuaria en México 42(3):447–458.
• Peruchena, CO. 2012. Los forrajes y la alimentación para intensificar la producción de carne del norte argentino (en línea). Consultado 29 jul. 2015. Disponible en http://bit.ly/38Jo8zl
• Rossi, CA; Gonzalez, GL; Lacarra, H; Pereyra, AM; Chagra Dib, EP. 2002. Evolución de la proteína bruta en hojas de seis especies de ramoneo del Chaco árido (en línea). Consultado 29 jul. 2016. Disponible en http//www.infogranjas.com.ar/index.php/agricultura/305
• Ramirez, J; Posada, S; Noguera, R. 2015. Effects of Kikuyu grass (Pennisetum clandestinum) age and different forage: concentrate ratios on methanogenesis. Revista MVZ Córdoba 20(3):4726-4738.
• Ramirez, J; Verdecia, D; Leonard, I. 2008. Rendimiento y caracterización química del Pennisetum Cuba CT 169 en un suelo pluvisol (en línea). Revista Electrónica de Veterinaria 9(5). Consultado 26 feb 2015. Disponible en http://bit.ly/2qQHd1w
• Ramírez R, O; Hernández G, A; Carneiro, S; Pérez, P; J; de Souza Júnior, J; Castro R, R; Enríquez Q, JF. 2010. Características morfogénicas y su influencia en el Rendimiento del pasto Mombaza, cosechado a diferentes intervalos de corte. Tropical and Subtropical Agroecosystems 12:303-311.
• Sá, JF; Pedreira, MS; Silva, FF; Bonomo, P; Figueiredo, MP; Menezes, DR; Almeida, TB. 2010. Fracionamento de carboidratos e proteínas de gramíneas tropicais cortadas em três idades. Arquivo Brasileiro de Medicina Veterinária e Zootecnia 62(3):667–676.
• Salcedo, G. 2000. Degradabilidad ruminal de la hierba en praderas aprovechadas bajo pastoreo rotacional en la zona costera de Cantabria. Investigación agraria. Producción y sanidad animales 15(3): 125–136.
• Sampedro, D; Vogel, O; Celser, R. 2004. Suplementación de vacunos en pastizales naturales. EEA. INTA. Mercedes, Corrientes Argentina. Serie Técnica N° 34.
• Santana, JR; Pereira, JM; Morero, MA; Spain, JM. 1993. Persistencia e qualidade proteica da consorciacao Brachiaria humidicola – Desmodium ovalifolium cv. Itabela sob diferentes sistemas e intensidades de pastejo. Pasturas Tropicales 15(2):2-8
• SAS Institute Inc. 2010. SAS/TATTM Guide for personal computers, Version 9.2. SAS Institute Inc. Cary, NC.
• Soares, JPG; Derezs, F; Arcury, PB; Salman, AKD; Oliveira, AD; Verneque, RS; Berchielli, TT. 2009. Degradabilidade ruminal e digestibilidade intestinal da proteína de capim-elefante com três idades de corte. Arquivo Brasileiro de Medicina Veterinária e Zootecnia 61(2):438–444.
• Soto, C; Reinoso, V. 2007. Suplementación proteica en ganado de carne. Veterinaria (Montevideo) 42(167):27–34.
• Spencer, D; Higgins, TJV; Freer, M; Dove, H; Coombe, JB. 1988. Monitoring the fate of dietary proteins in rumen fluid using gel electrophoresis. British Journal of Nutrition 60(2):241-247.
• Sun, XZ; Waghorn, GC. 2012. Improving in sacco incubation technique to evaluate fresh forage for selecting fast-degrading perennial ryegrass (Lolium perenne L.). Grass and Forage Science 67(3):437-445.
• Valderrama L, X; Anrique G, R. 2011. In situ rumen degradation kinetics of high-Protein forages crops in temperate climates. Chilean journal of agricultural research 71(4):572-577.
• Vaz Martins, D; Messa, A. 2007. Las bajas ganancias otoñales en bovinos, un fenómeno multicasual. Revista INIA (10):2-5.
• Vieira, RAM. 1995. Modelos matemáticos para estimativa de parâmetros da cinética da degradação do capim elefante cultivar Mineiro (Pennisetum purpureum, Schum.) em diferentes idades de corte. 1995 88 p. Dissertação (Mestrado em Zootecnia) – Universidade Federal de Viçosa, MG-UFV.
• Viera, FC; Nahas, E. 2005. Comparison of microbial numbers in soils by using various culture media and temperatures. Microbiological Research 160(2):197–202.
Derechos de autor 2018 Alcides L. Slanac, César D. Kucseva, Osvaldo Balbuena, Diego Rochinotti

Esta obra está bajo licencia internacional Creative Commons Reconocimiento-NoComercial-CompartirIgual 4.0.








