Evaluación en condiciones in vitro de la masa micelial de hongos fitopatógenos mediante el uso de filtrados de aislamientos de Trichoderma spp.
Resumen
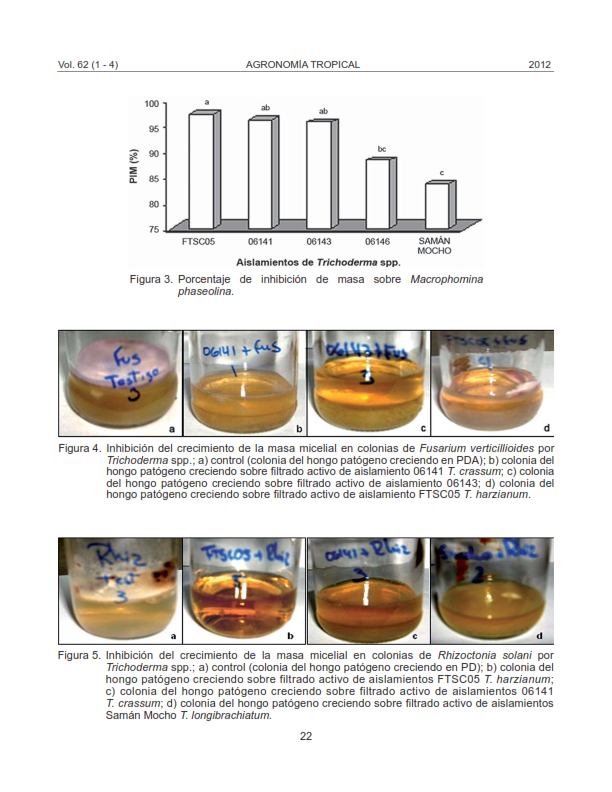
Se ha demostrado que las especies del género Trichoderma spp. producen metabolitos secundarios con actividad antifúngica, constituyéndose en un taxón de diversos grupos relacionados a su estructura y función, estos contienen componentes volátiles como no volátiles. Se evaluó la actividad metabólica de cinco aislamientos de Trichoderma spp. sobre el control in vitro de los hongos fitopatógenos Fusarium verticillioides, Rhizoctonia solani y Macrophomina phaseolina, causantes de las enfermedades: pudrición en tallo del maíz, mancha bandeada del maíz y pudrición carbonosa en caraota, respectivamente. Se utilizaron aislamientos antagonistas colectados de zonas de producción de los estados Aragua, Carabobo y Guárico, identificándolos a nivel de especie mediante estudios morfológicos. Para evaluar el mecanismo de antibiosis, los antagonistas se cultivaron en medio de cultivo líquido papa-dextrosa, la reproducción se efectuó de forma estática, se filtraron por separado utilizando papel de 100 μm, se centrifugaron, los sobrenadantes fueron filtrados utilizando papel de 0,22 μm. En los filtrados se colocaron discos de Papa Dextrosa Agar (PDA) colonizados con el patógeno, por un período de 15 días, luego se extrajo la masa micelial desarrollada y fue secada en estufa a 30 °C por 3 días, se pesó y se calculó el porcentaje de inhibición de masa micelial de cada patógeno. El aislamiento que presentó mejor control en todos los patógenos evaluados fue el perteneciente a T. crassum 06141 (94,47%), seguido de T. harzianum 06143 (92,35%), T. harzianum FTSC05 (91,94%), T. longibrachiatum Samán Mocho (85,86%) y T. harzianum 06146 (84,33%).
Descargas
Citas
• Baker, R. 1990. An overview of current and future strategies and models for biological control. In: Biological control of Soil-borne Plant Pathogens. Redw. Press. Melksham. Wiltshire. Hornby D (ed.). pp. 375-388.
• Bissett, J. 1991a.A revision of the genus Trichoderma II: Intrageneric classification. Canadian Journal of Botany. 69(11):2.357-2.372.
• Bissett, J. 1991b.A revision of the genus Trichoderma III: Section Pachybasium. Canadian Journal of Botany. 69(11):2.373-2.414.
• Bissett, J. 1991c. A revision of the genus Trichoderma IV: Aditional notes on section Longibrachiatum. Canadian Journal of Botany. 69(11):2.418-2.420.
• Bonnarme, P., A. Djian, A. Latrasre, G. Feron, C. Ginies, A. Durand and J. L. Le Querre.1997. Production of 6-pentyl-alfa-pyrone by Trichoderma spp., from vegetable oils. Journal of Biotechnology. 56(2):143-150.
• Goldman, G., C. Hayes y G. Harman. 1994. Molecular and Cellular biology of biocontrol by Trichoderma spp. TIBTECH. 12(12):478-482.
• González Salgado, C., A. Puertas Arias, M. Fonseca Flores, E. Suárez Soto y R. Blaya Gómez. 1994. Actividad antagónica de Trichoderma sp. aislada de un suelo de la provincia Granma, Cuba frente a Alternaria solani Sor. Rev. Fac. Agron. (LUZ). 16(2):167-173.
• Latiegui, A. 1990. Trichoderma harzianum. Rifai. como antagonista de Slerotium rolfsii Sacc., agente causal de pudrición basal de la caraota (Phaseolus vulgaris L.). Universidad Centro Occidental Lisandro Alvarado. Barquisimeto. Venezuela. 61 p.
• Pezet, R., V. Pont and R. Tabacchi. 1999. A simple analysis of 6-Pentyl-alpha-pyrone, a mayor antifungal metabolite of Trichoderma spp., useful for testing the antagonistic activity of these fungi. Phytoch. Annal. 10:285-288.
• Reyes, G. y C. Franco. 2006. Producción Biotecnológica de sabores, pigmentos y aromas a partir de hongos miceliales y levaduras. Universitas Scientiarum. Revista de la Facultad de Ciencias. Bogota, Colombia.11(2):23-30.
• Rifai, M. 1969. A revision of the genus Trichoderma. Mycological Papers 116. pp. 1-56
• Salazar, L. A., G. Y. Aponte, M. de J. Alcano, N.H. Sanabria y J. J. Guzmán, J. 2012. Importancia de las especies de Trichoderma para el control de Macrophomina phaseolina en las áreas agrícolas del estado Aragua, Venezuela. Agronomía Trop. 62(1 - 4):7-15.
• Stefanova, M., A. Leiva, L. Larrinaga y M. F. Coronado. 1999. Actividad metabólica de cepas de Trichoderma spp., para el control de hongos fitopatógenos del suelo. Rev. Fac. Agron. (LUZ). 16:509-516.
• Taylor, A. 1986. Some aspects of the chemistry and biology of the genus Hipocrea and its anamorphs, Trichoderma and Gliocladium. Proc. Nova Scotia Institute Science. 36(1):27-58.