Contenido de lípidos, ácidos grasos, exopolisacáridos y minerales de Arthrospira maxima cultivada en fotobiorreactores
Resumen
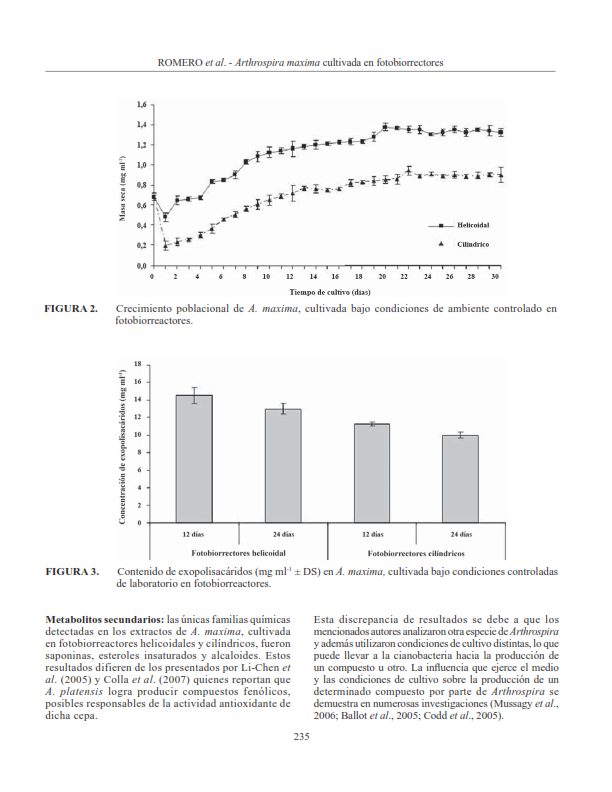
Esta investigación planteó la evaluación de la composición bioquímica de la biomasa de Arthrospira maxima obtenida en fotobiorreactores, bajo condiciones ambientales controladas. A tal efecto, esta cianobacteria fue cultivada de forma discontinua en fotobiorreactores helicoidales y cilíndricos, durante 30 d en medio Zarrouk. El crecimiento poblacional analizado, a través de la determinación de la biomasa seca, fue mayor en el fotobiorreactor helicoidal (1,37 mg ml-1). El mayor contenido de exopolisacáridos se encontró en el fotobiorreactor helicoidal a los 12 d de cultivo. En ambos sistemas de cultivo se detectaron saponinas, este- roles insaturados y alcaloides. El contenido promedio de lípidos totales obtenido en los fotobiorreactores helicoidales (6,05 ± 0,012%) no mostró diferencias significativas (P>0,05) con los determinados en los fotobiorreactores cilíndricos (5,76 ± 0,038%). El ácido palmítico fue el ácido graso que se encontró en mayor proporción (fotobiorreactor helicoidal = 43,84 ± 0,922% y fotobiorreactor cilíndrico = 44,87 ± 3,094%). Los ácidos grasos poliinsaturados 18:2n-6 y 18:3n-6 mostraron concentraciones similares en ambos tipos de fotobiorreactores (16 a 18%). Al culminar esta investigación se deja en evidencia que los dos sistemas de cultivo evaluados permiten obtener biomasa de Arthrospira maxima con altos contenidos de lípidos totales y ácidos grasos, además de minerales y compuestos químicos de interés para la medicina, las industrias farmacéuticas y alimenticias
Descargas
Citas
• American Public Health Association (APHA). American Water Works Association & Water Pollution Control Federation. 1980. Standards Methods for the Examination of Water and Wastewater. American Public Health Association, Washington, D.C. USA.
• Andrade, M. and J. Costa. 2007. Mixotrophic cultivation of microalga Spirulina platensis using molasses as an organic substrate. Aquaculture, 264:130-134.
• Ballot, A., L. Krienitz, K. Kotut, C. Wiegand and S. Pflugmacher. 2005. Cyanobacteria and cyanobacterial toxins in the alkaline crater lakes Sonachi and Simbi, Kenya. Harmful Algae, 4:139-150.
• Belay, A. 2002. The potential application of Spirulina (Arthrospira) as a nutritional and therapeutic supple- ment in health management. J. Am. Nutrac. Asso. 5(2):27-49.
• Bender, J. and P. Phillips. 2004. Microbial mats for multiple applications in aquaculture and bioremediation. Bioresour. Technol. 94: 229-238.
• Bligh, E. and W. Dyer. 1959. A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37:911-917.
• Chaumont, D. 1993. Biotechnology of algal biomass production: a review of systems outdoor may culture. J, Appl. Phycol. 5:593-604.
• Chamorro, G., M. Salazar, K. Gomes, C. Pereira, G. Ceballos y L. Fabila. 2002. Actualización en la farmacología de Spirulina (Arthrospira), un alimento no convencional. ALAN, 52: 232-240.
• Ciferri, O. 1983. Spirulina, the edible microorganism.Microbiol. Rev. 47(4):551-578.
• Codd, G., L. Morrison and J. Metcalf. 2005. Cyanobacterial toxins: risk management for health protection. Toxicol. Appl. Pharmacol. 203(3):264-272.
• Cogne, G., J. Cornet and J. Gros. 2005. Design, Operation, and Modeling of a Membrane Photobioreactor to Study the Growth of the Cyanobacterium Arthrospira platensis in Space Conditions. Biotechnol. Progr.21(3):741-750.
• Cohen, Z. 1997. The chemicals of Spirulina. In: Spirulina platensis: Physiology, Cell-biology and Biotechnology. A. Vonshak (ed). Taylor & Francis, London, 175-204 pp.
• Colla, L., E. Furlong y J. Vieira. 2007. Antioxidant properties of Spirulina (Arthospira) platensis culti- vated under different temperatures and nitrogen regimes. Braz.Arch. Of Biol. and Technol. 50(1):161-167.
• Contreras, C., J. Peña, L. Flores y R. Cañizares. 2003.Avances en el diseño conceptual de fotobiorreactores para el cultivo de microalgas. Interciencia, 28(8):450-456.
• De Philippis, R. and M. Vincenzini. 1998. Exocellular polysaccharides from cianobacteria and their possible applications. Microbiol. Reviews, 22:151-175.
• Domínguez, X. 1973. Métodos de Investigación Fitoquímica. Editorial Limusa. México, D.F. 2 81 pp.
• Eliach, J., G. Bourges, L. Duré, M. Medina y M. Lara. 2004. Incidencia de la agitación en el crecimiento microalgal en biorreactores. Pub. Secretaría de Ciencia y Técnica. Facultad de Ciencias Exactas, Ingeniería y Agrimensura. Universidad Nacional de Rosario, Rosario, Argentina. 15 p.
• Fuenmayor, G., N. Rosales, R. Mora y E. Morales. 2002. Crecimiento de la cianobacteria Spirulina subsalsa, a diferentes salinidades y concentraciones de bicarbonato. XXVIII Jornadas Nacionales de Microbiología, Barquisimeto, Venezuela.
• Leaf, A. and P. Weber. 1988. Cardiovascular effects of n-3 fatty acids. New England J. of Medicine. 318(9):549-557.
• Licet, B. 2008. Cultivo de Arthrospira platensis (División: Cyanophyta) a diferentes salinidades y fuentes de nitrógeno como estrategia para modificar su composición bioquímica. Trabajo de Grado de Maestría. Postgrado en Ciencias Marinas, Universidad de Oriente.
• Li-Chen, W., A. Ja-an, S. Ming-Chen y L. In-Wei. 2005. Antioxidant and antiproliferative activities of Spirulina and Chlorella water extracts. J. Agric. Food Chem. 53:4207-4212.
• Loreto, C., G. Fuenmayor, B. Briceño, N. Rosales y E.Morales. 2007. Calidad microbiológica y bioquímica de derivados comerciales de la cianobacteria Spirulina. Bo. Centr. Investig. Biol. 41:107-113.
• Marcano, D. y M. Hasegawa. 2002. Fitoquímica Orgánica.Consejo Científico, Univ. Central Venezuela, Caracas. 451 p.
• Marsh, J. and D. Weinstein. 1966. Simple charring method for determination of lipids. J. Lipids. Res. 7:574-592.
• Matsudo, M., Bezerra, R., Sato, S. Perego, P. Converti, A. and J. Carvalho. 2009. Repeated fed-batch cultivation of Arthrospira (Spirulina) platensis using urea as nitrogen source. Bioch. Engin. J. 43:52-57.
• Melack, J. and P. Kilham. 1974. Photosyntetic rates of photoplankton in East Africa alkaline, saline lakes. Limnol. Oceanogr. 19:743-755.
• Mühling, M., A. Belay and B. Whitton. 2005. Variation in fatty acid composition of Arthorospira (Spirulina) strains. J. Appl. Phycol. 17:137-146.
• Mussagy, A., H. Annadotter and G. Cronberg. 2006. An experimental study of toxin production in Arthrospira fusiformis (Cyanophyceae) isolated from African waters. Toxicon, 48:1 027-1 034.
• Naranjo, L., Rojas, D., González, H., Torres, R., Zegarra, J., Sena, L. y D. Sosa. 2010. Arthrospira platensis como biofactoría de metabolitos secundarios de interés farmacológico: el ácido pipecólico. Rev. Latinoam. Biotecnol. Amb. Algal, 1(1):64-90.
• Oliveira, M., M. Monteiro, P. Robbs and S. Leite.1999. Growth and chemical composition of Spirulina maxima and Spirulina platensis biomass at different temperatures. Aquacult. Internat. 7:261-275.
• Paoletti, C., M. Vincenzini, F. Bocci y R. Materassi. 1980. Composizione bioquímica generale delle biomasse di Spirulina platensis e S. maxima. In: Prospettive Della coltura di Spirulina in Italia. Materassi, R (Ed.). Italia.
• Pedraza, G. 1989. Cultivo de Spirulina maxima para suplementación proteica. Liv. Res. for Rural Dev. 1(1):1-6.
• Puyfoulhoux, G., J. Rouanet, P. Besancon, B. Baroux, J. Baccou and B. Caporiccio. 2001. Iron availability from iron-fortified Spirulina by an in vitro digestion/ CaCO cell culture model. J. Agric. Food Chem. 49:1 625-1 629.
• Rafiqul, I., K. Jalal and M. Alam. 2005. Environmental factors for optimization of Spirulina biomass in laboratory culture. Biotechnology, 4(1):19-22.
• Ramírez, L. y R. Olvera. 2006. Uso tradicional y actual de Spirulina sp. (Arthrospira sp.). Interciencia, 31(9):657-663.
• Reichert, C., C. Reinehr and J. Costa. 2006. Semicontinuous cultivation of the cyanobacterium Spirulina platensis in a closed photobioreactor. Brazilian J. of Chem. Engin. 23(1):23-28.
• Rojas, E., M. Ávila and G. Parada. 2012. Aplicación de estrategias nutricionales y su efecto en el crecimiento en el cultivo continuo de Spirulina (Arthrospira platensis). Lat. Am. J. Aquat. Res. 40(3): 763-771.
• Sato, N. and N. Murata. 1988. Membrane Lipids. Method Enzimol. 167:251-259.
• Seyoum, A., A. Belay, T. Baba and R. Ruprecht.1998. Inhibition of HIV-1 Replication by an Aqueous Extract of Spirulina platensis (Arthrospira platensis). J. Acquir. Immune Deficienc. Syndromes & Human Retrovir. 18 (1): 7-12.
• Silva, J., A. Pinto, H. Sabry and M. Carmo. 2012. Spirulina meal has acted as a strong feeding attractant for Litopenaeus vannamei at a very low dietary inclusion level. Aquacult. Research. 43:430-437.
• Sokal, R.R., and F.J. Rohlf. 1995. Biometry: The principles and practice of statistics in biological research. 3rd edition. W.H. Freeman, New York.
• Trabelsi, L., N. Houda, H. Ben Ouada, H. Bacha and S, Roudesli. 2009. Partial characterization of extracelular polysaccharides produced by cyanobacterium Arthrospira platensis. Biotech. and Bioproc. Engin. 14:27-31.
• Tredici, M..and G. Zittelli. 1997 Cultivation of Spirulina (Arthrospira) platensis in flat plate reactors. In: Spirulina platensis: Physiology, Cell-biology and Biotechnology. A. Vonshak (ed). Taylor & Francis, London, 117-130 pp.
• Venkataraman, G. 1981. Blue–green algae for rice production. FAO Soil Bull., 16:33-42.
• Vicente, V., E. Ríos, G. Calderón, R. Cañizales and R. Olvera. 2004. Detection, isolation, and characterization of exopolysaccharide produced by a strain of Phormidum 94 a isolated from an arid zone of Mexico. Biotechnol. and Bioeng. 85:306-310.
• Vonshak, A. 1997. Spirulina platensis (Arthrospira): physiology, cell biology and biotechnology. J. Appl. Phycol. 9:295-596.
• Wu, D. and N. Meydani. 1996. Gamma-Linolenic acid and immune function. In: Gamma-Linolenic acid: Metabolism and its roles in nutrition and medicine. Huang, S. and Mills, D. (Eds). AOCS Press. U.S.A.
• Zarrouk, C. 1966. Contribution I’étude d’ue cyanophycée. Influence de divers facteurs physiques et chimiques sur la croisse et la photosynth se de Spirulina maxima (Setch et Gardner) Geitler. Tesis Doctoral. Facultad de Ciencias, Universidad de París. Italia. 41 pp.