Caracterización química de lixiviados de pseudotallos y láminas foliares de plátano 'Hartón' en el estado Yaracuy
Resumo
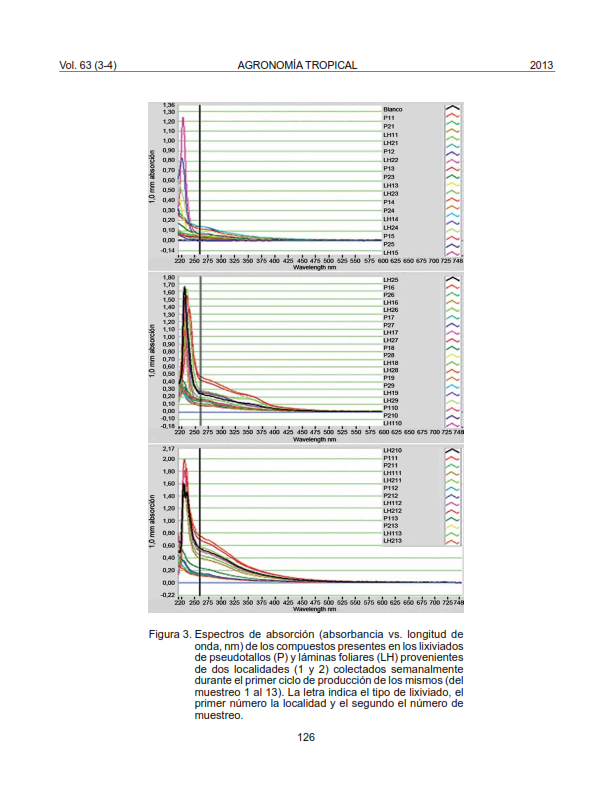
La obtención de lixiviados efectivos contra enfermedades de interés, al igual que su potencial como estimuladores de crecimiento en musáceas, surge como alternativa para el aprovechamiento de restos de cosecha del plátano (Musa AAB). Para caracterizar químicamente los lixiviados de pseudotallos (PS) y láminas foliares (LH) de plátano ʹHartón', biomasa proveniente de dos localidades con diferente manejo, fue colocada en recipientes plásticos para su descomposición, bajo un diseño experimental completamente aleatorizado y arreglo factorial 2x2 (tipo de lixiviado y localidad) y tres repeticiones. Se determinó la concentración de proteínas, macro y microelementos, ácidos húmicos y fúlvicos, espectros de absorción de cada lixiviado comparados con los de reguladores de crecimiento y la presencia de metabolitos secundarios. Se encontró que independientemente de la localidad, los compuestos analizados estuvieron presentes en los lixiviados. La mayor concentración de proteínas se obtuvo en los lixiviados de LH, alcanzando valores de 128 µg ml-1. El potasio fue el elemento más abundante en ambos extractos, representando el 77% de la composición de macroelementos. Solo se detectaron ácidos húmicos y fúlvicos en lixiviados de LH en concentraciones de 0,06 y 0,35%, respectivamente. Los máximos de absorción entre 220 y 250 nm obtenidos para los lixiviados, coincidieron con los de auxinas y citocininas. Los metabolitos secundarios observados en mayor intensidad fueron: flavonoides, alcaloides, ácidos carboxílicos, antraquinonas y fenoles. La presencia de proteínas, nutrimentos, metabolitos secundarios y reguladores de crecimiento en los lixiviados estudiados, infieren propiedades para el control de enfermedades y la promoción del crecimiento en plantas.
Downloads
Referências
• Alonso-Calderón A., J. Pérez-Curiel, C. Montiel- Salinas, G. Geissler, M. T. Zayas-Pérez y M. L. O. Villegas-Rosas. 2008. Eliminación de fenol, 2-clorofenol y colorantes en aguas artifi- cialmente contaminadas y aguas residuales textiles utilizando a la peroxidasa de chayote. Revista Latinoamericana de Recursos Naturales 4(2):278-284.
• Amirjani M.R. 2013. Effects of drought stress on the alkaloid contents and growth parameters of Catharanthusroseus. ARPN Journal of Agricultural and Biological Science 8(11):745-750.
• Arango-Acosta G. J. 2008. Alcaloides y compuestos nitrogenados. Universidad de Antioquia, Colombia. 84 p. Disponible en línea: https://bit.ly/2wdM0N9 [Ago. 19, 2014).
• Ariza E. 2012. Determinación del perfil de compuestos fenólicos en arazá (Eugenia stipitata), Univer- sidad Nacional de Colombia. 18 p. Disponible en línea: https://bit.ly/2IQ66Qn [Ago. 19, 2014].
• Babatunde G.M. 1991. Availability of banana and plantain products for animal feeding.In Roots, tubers, plantains and bananas in animal feeding (David Machinand SolveigNyvoldEditores), ISBN 92-5-103138-X.FAO Animal Production and Health Paper 95. pp. 251-276.
• Bezerra de Barros I., J.F. de Souza-Daniel, J. Pereira-Pinto, M.I. Rezende, R. Braz-Filho and D. Trevisan-Ferreira. 2011. Phytochemical and antifungal activity of anthraquinones and root and leaf extracts of Coccolobamollis on phytopathogens. Braz. Arch. Biol. Technol.54(3):535-541.
• Belalcázar C., J. Valencia y J. Lozada. 1991 La planta y el fruto. En: Belalcázar, S (ed) Manual de Asistencia Técnica No. 50 ICA, El cultivo del plátano en el trópico. Armenia, Quindío, INIBAP. Feriva, Cali. pp. 45-89.
• Blanco G. 2010. Evaluación participativa de extractos vegetales promotores del crecimiento en plátano (Musa AAB) en condiciones de vivero, en el asentamiento Campesino Macagua-Jurimiquire, municipio Veroes, estado Yaracuy. Informe de Proyecto del Doctorado de Biotecnología Agrícola de la Escuela Socialista de Agricultura Tropical (ESAT). 31 p.
• Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of Protein-Dye Binding. Analytical Biochemistry 72:248-254.
• Dave H. and L. Ledwani. 2012. A review on anthraquinones isolated from Cassia species and their applications. Indian Journal of Natural Products and Resources 3(3):291-319.
• Espinosa J. y F. Mite. 2012. Búsqueda de eficiencia en el uso de nutrientes en banano. International Plant Nutrition Institute. Disponible en línea: https://bit.ly/2Ua92MV [Jun. 22, 2012].
• Flórez V.J. y M. de F. D. Aleixo P. 2008. Concentraciones opuestas de AIA-ABA aceleran el desarrollo floral de Solidago x luteus. Agronomía Colombiana 26(2), 237-245.
• Garcés H. H.M. 2010. Comparación de la calidad y efectos de lixiviados obtenidos a partir de raquis de banano (Musa acuminata) y plátano (Musa balbisiana) mediante transformación aeróbica y anaeróbica en condiciones de invernadero. Trabajo de Grado para la obtención del título de Ingeniero Agropecuario, Escuela Politécnica del Litoral, Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Guayaquil, Ecuador. 133 p.
• Hegab M.M. and H.R. Ghareib. 2010. Antioxidative effects of acetona fraction and vanillic acid from Chenopodiummurale L. on tomato plant. Weed Biology and Management 10(1):64-72.
• Hernández J. y S. Zamora. 2001. Desarrollo rural sostenible para las zonas productoras de plátano del estado Yaracuy. INIA-Secretaría de Desarrollo Agrícola de la Gobernación del estado Yaracuy. 158 p.
• Hernández F. J.B., A.E. Cañizares CH., G. Blanco, I. Arrieche, A. Pérez, C. Salazar y M. González. 2009. Contenido de nitrógeno, fósforo y potasio en harinas de clones de musáceas comestibles (Musa spp.). Revista UDO Agrícola 9(2):499-457.
• Ibañez J. J. 2007. Biodisponibilidad de los nutrientes por las plantas, pH del suelo y el complejo de cambio o absorbente. Disponible en línea: https://bit.ly/38OOUFy. [Jun. 22, 2012].
• InfoStat, 2013e. InfoStat profesional. Software versión 2.0. Estadística y diseño. Universidad Nacional de Córdoba, Argentina.
• Linares B. 2009. Informe de seguimiento técnico anual del proyecto “Fortalecimiento de cadenas de valor de plátano: Innovaciones tecnológicas para reducir agroquímicos”, caso Venezuela. FONTAGRO-INIA Yaracuy, Venezuela. 10 p.
• López A., J. Vargas, J. Espinoza y R. Vargas. 2001. Síntomas de deficiencias nutricionales y otros desórdenes fisiológicos en el cultivo del banano (Musa AAA). Guía de campo. Internacional Plant Nutrition Institute, Quito, Ecuador. 53 p.
• Marcano D. y M. Hasegawa. 2002. Fotoquímica orgánica. Segunda edición. Consejo de Desarrollo Científico y Humanístico. Universidad Central de Venezuela. Editorial Torino, Caracas, Venezuela. 588 p.
• Mazzeo M.M., L. León A., L. F. Mejía G., L.E. Guerrero M. y J.D. Botero L. 2010. Aprovechamiento industrial de residuos de cosecha y poscosecha del plátano en el Departamento de Caldas. Revista Educación e Ingeniería (9):128-139.
• Ortiz B. M.F. 2009. Evaluación de la actividad de los lixiviados de raquis de banano (Musa AAA), plátano (Musa AAB) y banano Orito (Musa AA) sobre el agente causal de la sigatoka negra (Mycosphaerella fijiensis Morelet) en condiciones in vitro. Trabajo de Grado para la obtención del título de Ingeniera Agropecuaria. Escuela Politécnica del Litoral. Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Guayaquil, Ecuador. 110 p.
• Román-Moreno L.F. y M.A. Gutiérrez-Coronado. 1998. Evaluación de ácidos carboxílicos y nitrato de calcio para incrementar calidad, cantidad y vida de anaquel en tres tipos de melón. Terra Latinoamericana 16(1):49-54.
• Sandoval-Rangel A., A. Benavides-Mendoza, M.A. Alvarado-Vázquez, R. Foroughbakhch- Pournavab, M.A. Núñez-González and V. Robledo-Torres. 2011. Influencia de ácidos orgánicos sobre el crecimiento, perfil bromato- lógico y metabolitos secundarios en chile piquín. Terra Latinoamericana 29(4):395-401.
• Stalikas C.D. 2007. Extraction, separation and detection methods for phenolic acids and flavonoids. V. Sep. Sci. 30:3.268-3.295.
• Urdaneta G. L.M., A.E. Delgado A., L. Sosa and A. Piñeiro. 2002. Micobiota del filoplano en plátano Hartón (Musa AAB), en el municipio Francisco Javier Pulgar del estado Zulia, Venezuela. Rev. Fac. Agron. (LUZ) 19:95-108.
• Waller G.R. and E.K. Newacki. 1978. Alkaloid Biology and Metabolism in Plants. Plenum Press, New York, ISBN-13:1468407724, 9781468407723. 294 p.