Caracterización de la variabilidad genética mediante el uso de marcadores RAPDs, de un grupo de genotipos nativos y comerciales de caraota en Venezuela
Resumen
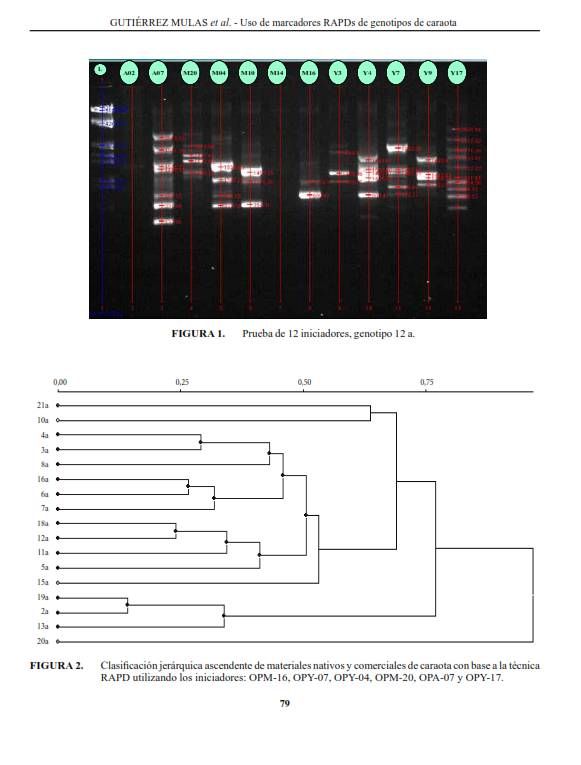
El objetivo de este trabajo fue caracterizar la variabilidad genética de la caraota, Phaseolus vulgaris l., en un grupo de genotipos nativos, colectados en sistemas de producción de pequeños agricultores y variedades comerciales del Banco de germoplasma de leguminosas de grano del centro Nacional de Investigaciones Agropecuarias (CENIAP), Venezuela; para ello, se utilizaron marcadores moleculares RAPDs, de los cuales resultaron útiles los primers o iniciadores de la serie M y Y (opM16 y opY17), por su eficiencia en la separación entre genotipos cultivados y nativos. los primers opM-16, opY-07, opY-03, opY-04, opM-20, opA-07 y opY-17 produjeron 47 fragmentos de amplificación reproducibles, permitiendo la clasificación de nativos y comerciales en seis grupos, y separando al testigo comercial y una línea mejorada de los demás genotipos evaluados. Los grupos resultan útiles a los fines de proponer un programa de mejora genética, incluyendo la ampliación de la base genética, para cultivares. los de color negro, pudieron mejorarse a partir de cruzamientos de Tacarigua (grupo I) con los genotipos de 19 y 13 (grupo IV), distantes en 0,75 unidades ultramétricas (UUM). También se puede cruzar la línea mejorada 13 (grupo VI) con los genotipos 6 y 12 (grupo III) a 0,75 UUM. Además, es recomendable ensayar cruces con el genotipo 12, por haber presentado también un bajo índice de susceptibilidad a la sequía. los genotipos de otros colores se pueden mejorar con el cruce del genotipo 10, rosado (grupo II) con el genotipo 2 de color blanco (grupo V), a 0,60 UUM.
Descargas
Citas
• Beebe, S. E., I. Ochoa, P. Skroch, J. Nienhuis and J. Tivang. 1995. genetic Diversity among common bean breeding lines developed for central América. Crop Sci. 35(5):1 178-1 183.
• Beebe, S., P. W. Skroch, J. Thome, M. C. Duque, F. Pedraza and J. Nienhuis. 2000. Structure of genetic diversity among common bean landraces of middle American origin based on correspondence analysisi of RAPD. Crop Sci., 40(1):264-273.
• Beebe, S., J. Rengifo, E. Gaitan, M. C. Duque and J. Thome. 2001. Diversity and origin of Andean landraces of common Bean. crop Science. 41:854-862.
• Berthaud, J. 1997. Strategies for conservation of genetic resources in relation with their utilization. Euphytica.96:1-12.
• Brucher, O. B. and H. Brucher. 1976. The South American wild bean (Phaseolus aborigieus Burk.) as ancestor of the common bean. Economic Botany. 30(3):257-272.
• Constabel, E. C., T. E. Michaels, P. H. Goodwin, J. E. Mayer and M. A. Pastor. 1996. Evaluation of a DNA probe for the quantitative detection of common bacterial blight in common bean and its application in a verdín program. Euphytica. 90:129-135.
• Debouck, D. G., O. Toro, O. M. paredes, W. C. Johnson and P. Gepts. 1993. genetic diversity and ecological distribution of Phaseolus vulgaris (Fabaceae) in northwestern South America. Economic Botany, 47(4):408-423.
• Dice, l. R. 1945. Measures of the amount of ecologic association between species. Ecology. 26:297-302.
• Faleiro, F. G., W. S. Vinhadelli, V. A. Ragagnin, R. X. correa, M. A. Moreira and E. G. de Barros. 2000. RAPD markers linked to a block of genes conferring rust resistance to the common bean. Genet. Mol. Biol. 23(2):399-402.
• Fall, A. l., P. F. Byrne, G. Jung, D. P Coyne, M. A. Brick and H. F. Schwartz. 2001. Detection and mapping of a major locus for Fusarium wilt resistance in common bean. Crop Science, 41:1494-1498.
• Ferreira Da Silva, G., J. B. Dos Santos and M. A. Patto. 2003. Identification of SSR and RApD markers linked to a resistance allele for angular leaf spot in the common bean (Phaseolus vulgaris) line ESAl 550. Genetics and Molecular Biology. 26(4):459-463.
• Ferreira, C. F., A. Borém, g. A. Carvalho, S. Nietsche, T. J. Paula Jr., E. G. Barros and M. A. Moreira. 2000. Inheritance of angular leaf spot resistance in common bean and identification of a RAPD marker linked to a resistance gene. crop Science. 40:1 130-1 133.
• Fofana, B. J. P., J. P. Baudion and P. Du Jardin. 1998.Molecular phylogeny in the genus Phaseolus. 3rd European conference on grain legumes. oportunities for high quality, healthy and added-value crops to meet European demands. Valladolid, España. 214-215 pp.
• Fofana, B., X. Vekemans, P. Du Jardin and J. P. Baudion. 1997. Genetic Diversity in lima Bean (Phaseolus lunatus) as reveled by RApD markers. Euphytica,95:157-165.
• Freyre, R., R. Rios; l. Guzman, D. G. Debouck and P. Gepts. 1996. Ecogeographic distribution of Phaseolus spp. (Fabaceae) in Bolivia. Economic Botany. 50(2):195-216.
• Gutiérrez, M. 2009. Caracterización ecofisiológica y molecular de materiales locales de caraota (Phaseolus vulgaris l.) colectados en Venezuela, ante condiciones de déficit hídrico. Tesis de grado para optar al título de Doctora en ciencias Agrícolas. Universidad Central de Venezuela. 69 p.
• Haley, S. D., P. N. Miklas, l. Afanador and J. D. Kelly. 1994. Random amplified polymorphic DNA (RAPD) marker variaility between and within gene pools of common bean. J. Amer. Soc. Hort. Sci. 119:122-125.
• Jaffé, W. G. and G. Karl. 1959. Purificatión of a toxic phytohaemagglutinin from Black Beans (Phaseolus vulgaris). Nature. 183:1 329-1 330.
• Jaffé, W. G. and K. Hannig. 1965. Fractionation of proteins from kidney beans (Phaseolus vulgaris). Arch. Biochem. Biophys. 109:80-91.
• Jaffé, W. G. y O. Brucher. 1968. La Presencia de fitohemaglutinina en Phaseolus aborigineus (Burk) y su identidad con la de Phaseolus vulgaris l. como argumento quimiotaxonómico de la íntima relación de estas dos especies. Rev. Acta Científica Venezolana. 19:20.
• Karp, A. 2002. The new genetic era: will it help us in managing genetic diversity. In managing plant genetic diversity. Edited by J. M. M. Engels, V. Ramanatha Rao, A. H. D. Brown and M. T, Jackson. CABI Publishing. 487 p.
• Kaplan, l. 1965. Archeology and domestication in American Phaseolus (Bean). Econ. Bot. (19):358-368.
• Koenig, R. l., S. P. Singh and P. Gepts. 1990. Novel phaseolin Types in wild and cultivated common bean (Phaseolus vulgaris, Fabaceae). Economic Botany, 44(1):50-60.
• Koinange, E. M., S. Singh and P. Gepts. 1996. genetics control of the domestication syndrome in common bean. crop Sci, 36:1 037-1 045.
• lowe, A. J., O. Hanotte and l. Guarino. 1996. Standardization of molecular genetic techniques for the characterization of germplasm collections: the case of random amplified polymorphic DNA (RAPD). Plant genetic Resources Newsletter, 107:50-54.
• Mailer, R. D., R. Scarth and B. Fristensky. 1994. Discrimination among cultivars of rapeseed (Brassica napus) using DNA polymorphisms amplified from arbitary primers. Theoretical and Applied genetics, 87:697-704.
• Métias, I., C. Aubry, B. Hamon, R. Jalouzot and D. Peltier. 2000. Description and analysis of genetic diversity between commercial bean lines (Phaseolus vulgaris). Theoretical and Applied Genetics, 101(8):1 207-1 214.
• Miklas, P. N., W. C. Johnson and R. Delorme and P. gepts. 2001. QTlconditioning physiological Resistance and Avoidance to White Mold in Dry Bean. Science. 41:309-315.
• Mitrick, J. A., J. Nienhnis, P. Hinrichsen and C. Muñoz. 1995. RApID Analysis of phaseolus vulgaris lan- drace from chile. Department of Biological Science Northern Illinois University De Kalb, Department of Horticulture, University of Wisconsin, Madison, Instituto Nacional de Investigaciones Agropecuarias, Santiago, chile, Plant genome III, January 1995.
• Nowosielski, J., W. Podyma and D. Nowosielska. 2002. Molecular research on the genetic diversity of polish varieties and landraces of Phaseolus coccineus l. and Phaseolus vulgaris l. using the RApD and AFlp methods. cell Mol Biol lett, 7(2B):753-762.
• Park, Soon O., D. P. Coyne, J. R. Steadman and P. W. Skroch. 2001. Mapping of QTl for Resistance Mold Disease in common Bean. Crop Science, 41:1 253-1 262.
• Quirós, C. F., J. Hu, P. This, A. M. Chevre and M. Delseny. 1991. Development and chromosomal localization of genome-specific markers by the polymerase chain reaction. Theoretical and Applied genetics, 82:627-632.
• Sánchez, M., S. Hernández, P. Guzman and J. Simpson. 1995. A simple protocol for the isolation of High Molecular Weight DNA Molecular from common Bean (P. vulgaris). Department of genetic Engineering. centro de Investigaciones y Estudios Avanzados (CINVESTAV), Unidad Irapuato Apdo postal 629, Irapuato México.
• Sing, S. P., P. Gepts and D. G. Debouck. 1991a. Races of common Bean (Phaseolus vulgaris, Fabaceae). Economy Botanic, 45(3):79-396.
• Sing, S. P., J. A. Gutiérrez, A. Molina, C. Urrea and P. Gepts. 1991b. Genetic Diversity in common Bean: II. Marked-Based Analysis of Morphological and Agronomics Traits. crop Sciece, 31:23-29.
• Skroch paul, W., J. Nienhuis, S. Beebe, J. Thome and F. Pedraza. 1998. Comparison of Mexican Common Bean (Phaseolus vulgaris l.) core and Reserve Germplasm Collections. Crop Science, 38:488-496.
• Vekemans, X., O. Hardy, B. Berken, B. Fofana and J. Baudoin. 1998. Use of PCR-RFLP on chloroplast DNA to investigate phylogenetic realtionships in the genus phaseolus. Biotechnologie, Agronomie Societe et Environnement. 2(2):128-134.
• Voysest, O. 2000. Mejoramiento genético del frijol (Phaseolus vulgaris L.) legado de variedades de América latina 1930-1999. centro Internacional de Agricultura Trop. Cali Colombia. 195 p.
• Welsh, J. and M. Mcclelland. 1990. Fingerprinting genomes using pcR with arbitrary primers. Nucleic Acids Research, 18(24):7 213-7 218
• Williams, J. G. K., A. R. Kubelik, K. J. Livak, J. A. Rafalski and S. V. Tingey. 1990. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers. Nucleic Acids Research, 18(22):6 531-6 535.
• Yang, X. and C. Quiros. 1993. Identification and classification of celery cultivars with RAPD markers. Theoretical and Applied Genetics, 86:205-212.
• Zambrano, A. Y., J. R. Demey, G. Martínez, F. Fuenmayor, Z. Gutiérrez, G. Saldaña y M. Torrealba. 2002. Método rápido, económico y confiable de mini preparación de ADN para amplificaciones por RAPD en bancos de germoplasma. Agronomía Trop.,52(2):235-243.