Comparison of two methods for detection of Xanthomonas phaseoli on bean seeds (Phaseolus vulgaris L.)
Abstract
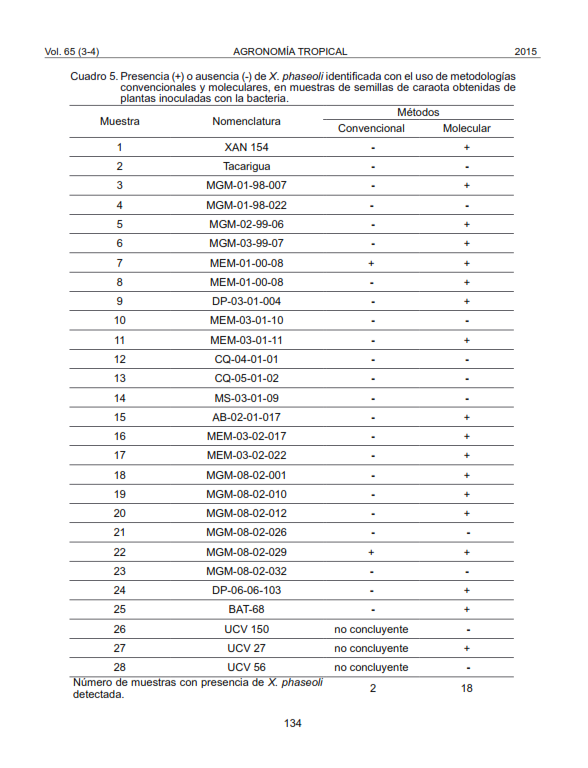
According to laboratory conditions and resources, two methodologies were compared in order to identify the most effective method to detect the presence of common bacterial blight caused by Xanthomonas phaseoli in black bean seeds (Phaseolus vulgaris L.). The seeds were taken from 28 accessions of plants previously inoculated under greenhouse conditions. Conventional methods, including morphological, physiological and biochemical tests, using 24 hours pure bacteria colonies, obtained directly from seedlings grown on nutrient agar from seeds treated in disinfected and non-disinfected conditions were performed; also the molecular technique of polymerase chain reaction. The conventional method permitted the detection of the bacterial pathogen in two accessions of seeds, whereas 18 were identified with the molecular method. The conventional method was less effective and required longer time for results compared to the molecular method, with higher cost.
Downloads
References
• Bradbury, J. 1984. Genus II. Xanthomonas Dowson. In: Krieg (ed). Bergeys Manual of Systematic Bacteriology Vol I. Baltimore, USA. William and Wilkins. pp. 199-210.
• Cafati, C. R. and A.W. Saettler. 1980. Effect of host on multiplication and distribution of bean common blight bacteria. Phytopathology. 70:675-679.
• Castañeda H., R. 2010. Evaluación molecular de la resistencia a la bacteriosis común (Xanthomonas phaseoli) y del rendimiento, en familias F de caraota (Phaseolus vulgaris L.). Tesis de Maestría. Universidad Central de Venezuela, Facultad de Agronomía, Maracay, Venezuela. 70 p.
• Contreras, N., G. Trujillo, O. Borges y F. Centeno. 2001. Análisis ultraestructural de la interacción de Xanthomonas axonopodis pv. Phaseoli con genotipos resistentes, moderadamente resistentes y susceptibles de Phaseolus vulgaris L. Intercencia. 26(11):554-557.
• Cruz-Izquierdo, S., P. Ramírez-Vallejo, B. Tlapal- Bolaños, I. Ramírez-Ramírez, R. García- Espinoza, J. Sandoval-Islas, y F. Castillo- González. 2001. Producción masiva de Xanthomonas axonodopis pv. phaseoli (Smith) Dye. Agrociencia. 35:575-581.
• Gepts, P. and M. T. Clegg. 1989. Genetic diversity in Pearl Millet (Pennisetum glaucum [L.] R. Br.) at the DNA sequence level. The Journal of Heredity. 80(3):203-208.
• Gepts, P., V. Llaca, R. O. Nodar and L. Panella.1992. Analysis of seed proteins, isozymes and RFLPs for genetic and evolutionary studies in Phaseolus. In: Linskens H-F, Jackson JF (eds.), Modern methods of plant analysis (New Series). Seedanalysis. Spinger, Berlin. pp. 63-93.
• Guzmán-Piedrahita, Ó. A., J. Castaño-Zapata y B. Villegas-Estrada. 2009. Diagnóstico de enfermedades de plantas de origen biótico. Agronomía. 17(2):7-24.
• Karavina, C., J. Chihiya and T. A. Tigere. 2008. Detection and characterization of Xanthomonas phaseoli (E. F. Smith) in common bean (Phaseolus vulgaris L.) seeds collected in Zimbabwe. In: Journal of Sustainable Development in Africa. 10(1):105-119.
• Lagarde, P., A. Medina, C. Ramis y A. Maselli. 2010. Evaluación de la resistencia a la bacteriosis común causada por Xanthomonas phaseoli en plantas F de caraota (Phaseolus vulgaris L.). Fitopatología Venezolana. 23(2):35-39.
• Montoya-Estrada, C. N. y J. Castaño-Zapata. 2009. Microorganismos asociados con granos de fríjol (Phaseolus vulgaris L.), variedad Cargamanto Blanco. Agronomía. 17(2):25-35.
• Morros, M. E. 2001. Cultivo de la caraota con énfasis en el estado Lara. Maracay, Venezuela. Instituto Nacional de Investigaciones Agrícolas. Centro de Investigaciones Agrícolas del estado Lara. (Serie D Nº 2). 74 p.
• MPPAT (Ministerio del Poder Popular para la Agricultura y Tierras). 2015. Base de datos de la Dirección de Estadística. Caracas- Venezuela.
• Mutlu, N., K. Vidaver, D. P. Coyne, J. R. Steadman P. A. Lambrecht and J. Reiser. 2008. Differential Pathogenicity of Xanthomonas campestris pv. phaseoli and X. fuscans subsp. fuscans Strains on Bea Plant Disease. 92(4):546-554.
• Murray, M. G. and W. F. Thompson. 1980. Rapid isolation of high molecular weight DNA. Nucleic Acids Res. 8:4321-4325.
• Noval, C. 1991. Género Xanthomonas. In: Andres, M.; Arias, M y Bello, A. (eds). Manual de laboratorio, diagnóstico de hongos, bacterias y nematodos fitopatógenos. Ministerio de Agricultura, Pesca y Alimentación. Madrid, España. pp.285-312.
• Nunes, W., M., Corazza, S. Dias de Souza, S. Mui Tsai and E. Kuramae. 2008. Characterization of Xanthomonas axonodopis pv. phaseoli isolates. Botucatu, Brazil. Summa Phytopathol. 34(3):228-231.
• Pérez, D., N. Camacaro, M. E. Morros y A. Higuera. 2013. Leguminosas de grano comestible en Venezuela. Caraota, frijol y quinchoncho. Agricultura en Venezuela Nº 1. José Luis Berroterán (Editor). Ediciones ONCTI, Caracas. 157 p.
• Ramis, C, O. Movil, M. Maselli, A. Medina y D.Pérez. 2008. Estudio de la herencia de la resistencia a Xanthomonas phaseoli en una población F2 de caraota (Phaseolis vulgaris L.). III Congreso Venezolano de Mejoramiento Genético y Biotecnología Agrícola (III CONVEME). Barquisimeto, Venezuela. 25 al 27 de junio 2008.
• Roth, D. A. 1995. Review of extraction and isolation methods in Saettler et al. 1995. Detection of bacteria and other planting material. APS Press. St. Paul, Minnnesota. pp. 3-16.
• Saettler, A. 1991. Diseases caused by bacteria.In: Hall, R. (ed).Compendium of bean diseases. The American Phytopathological Society Press. USA. pp. 29-31.
• Sánchez, G., T. M. 2012. Diagnóstico y caracterización molecular de Xanthomonas albilineans (Ashby) Dowson en variedades comerciales de caña de azúcar Saccharums pp., en Venezuela. Tesis. Doctorado en Ciencias Agrícolas. Facultad de Agronomía, Universidad Central de Venezuela. 111 p.
• Schaad, N. W., J. B. Jones and W. Chun. 2001. Laboratory guide for identification of plant pathogenic bacteria. 3era Ed. The American Phytopathological Society. St Paul, Minnesota. USA. 371 p.
• Sutton, M. D. and V. R. Wallen. 1970. Epidemiological and ecological relations of Xanthomonas phaseoli and Xanthomonas phaseoli var. fuscans on bean in Southwestern Ontario. Canadian. pp. 1329- 1334.
• Trujillo, G., Y. Hernández y L. Gómez. 2005.Metodología fácil para la extracción y detección de bacterias fitopatógenas de semillas de caraota (Phaseolus vulgaris L.) y frijol (Vigna unguiculata (L.) Walp). Notas Técnicas. Fitopatología Venezolana. 18(2):37-39.
• Trujillo, G. 1998. Fundamentos de Bacterias Fitopatógenas. Facultad de Agronomía, Universidad Central de Venezuela. Rev. Alcance 56. 187 p.
• Trujillo, G. 1989. La problemática de las semillas de leguminosas comestibles en relación con los patógenos de planta. Caso: Venezuela. Agronomía al Día. 2:30-32.
• Toth, I. K., L. J. Hyman, R. Taylor and P. R. J. Birch. 1998. PCR-based detection of Xanthomonas campestris pv. Phaseoli var. fuscans in plant material and its differentiation from X. c. pv. phaseoli. Journal of Applied Microbiology. 85:327-336.