Aclimatación de tres especies de leguminosas mediante bioendurecimiento con microorganismos benéficos
Resumen
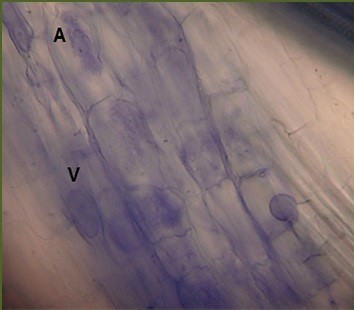
Las semillas de Calopogonium sp., Stylosanthes capitata y Cassia moschata presentan un estado de latencia prolongada que limita su germinación. Una alternativa de propagación es por cultivo in vitro, y para mejorar la adaptación al ambiente terrestre se utiliza el procedimiento de bioendurecimiento. El objetivo de la investigación fue evaluar el efecto de inoculación con microorganismos benéficos en la aclimatación de esas tres especies de leguminosas. Se seleccionaron 16 plantas para cada tratamiento, de las tres especies obtenidas de germinación in vitro. Para su aclimatación se sembraron en un sustrato, en envases de 250 mL. Los tratamientos fueron: inoculación de hongos Glomeromycota (HMA), inoculación con hongos Glomeromycota y Rhizobium phaseoli (HMA + R), control sin microorganismos (SM). Se determinó la sobrevivencia en un periodo de cinco meses. Calopogonium sp. mostró un 16 % de sobrevivencia a los cinco meses y 85 nódulos.planta-1 para el tratamiento HMA+R y 40 % de colonización micorrízica en el tratamiento HMA, lo que favoreció su aclimatación. S. capitata tuvo un 25 % de sobrevivencia con HMA y mostró menor cantidad de nódulos (5 nódulos.planta-1 con HMA + R, e insuficiente cantidad de raíces para cuantificar la micorrización. C. moschata inoculada con HMA alcanzó 13 % de sobrevivencia, sin formación de nódulos. La inoculación con microorganismos fue diferencialmente beneficiosa en la aclimatación de estas leguminosas y su efecto se potenció con la doble inoculación HMA+ R. La aclimatación de plantas obtenidas in vitro es vital para su establecimiento definitivo y es diferente para cada especie.
Descargas
Citas
• Azcón-Aguilar, C; Barceló, A; Vidal, MT; De la Viña, G. 1992. Futher studies on the influence of mycorrhizae on growth and development of micropropagated avocado plants (en línea). Agronomie 12(10):837-840. Consultado 13 jul. 2020. Disponible en https://bit.ly/3jiw16n
• Azcón-Aguilar, C; Cantos, M; Troncoso, A; Barea, JM. 1997. Beneficial effect of arbuscular mycorrhizas on acclimatazion of micropropagated cassava plantlets. Scientia Horticultural 72:63-71.
• Barea, JM. 2015. Future challenges and perspectives for applying microbial biotechnology in sustainable agriculture based on a better understanding of plant- microbiome interactions . Journal of Soil Science and Plant Nutrition 15(2):261-282.
• Calderón, L; Gómez, L; Blanco, F; Uribe, L. 2000. La inoculación con Glomus manihotis sobre el crecimiento y desarrollo de plantas de yuca producidas in vitro, en la fase de aclimatización. Agronomía Costarricense 24(2):25-29.
• Cano, MA . 2011. Interacción de microorganismos benéficos en plantas: micorrizas, Trichoderma spp. y Pseudomonas spp. Una revisión. Revista U.D.C. A . Actualidad & Divulgación Científica 14(2):15-31.
• Chalk, PM; Souza, RF; Urquiaga, S; Alves, BJR; Boddey, RM. 2006. The role of arbuscular mycorrhiza in legume symbiotic performance (en línea). Soil Biology and Biochemistry 38(9):294 4 -2951. Consultado 11 may. 2020. Disponible en https:// doi.org/bcjrwq
• Chikkalaki, S; Patil, SN; Venkateshalu. 2017. Bio hardening in micropropagation. International Journal of Botany and Research 7(2):21-24.
• Datta, A; Singh, RK; Kumar, S; Kumar, S. 2015. An Effective and Beneficial Plant Growth Promoting Soil Bacterium “Rhizobium”: A Review. Annals of Plant Sciences 4(01):933-942.
• Decklerk, S; Risede, JM; Delvaux, B; 2002. Greenhouse response of micropropagated bananas inoculated with in vitro monoxenically produced arbuscular mycorrhizal fungi. Scientia Horticulturae 93(3-4):301-309.
• Depablos, L; Ordóñez, J; Godoy, S; Chicco, CF. 2009. Suplementación mineral proteica de novillas a pastoreo en los Llanos Centrales de Venezuela. Zootecnia Tropical 27(3):249-262.
• Escandón, A S; Fer rer i, P; Facciuto, G; S oto, S; Hagiwara, JC; Acevedo, A. 2003. Combinación de técnicas in vitro y ex vitro para la micropropagación de Santa Rita (hibr.) Una arbustiva de relevancia ornamental. RIA . Revis ta de Investigaciones Agropecuarias 32(1):111-112.
• Fernández, K; Fernández, F; González, ME; Pérez, E; Mirabal, L; Pazos, M. 2002. Micorrización in vitro de plantúlas de Coffea canephora Var. Robusta: ¿Una realidad? Cultivos Tropicales 23(3):47-52.
• Giovannetti, M; Mosse, B. 1980. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots (en línea). New Phy tologist 8 4:489 -500. Consultado 11 may. 2020. Disponible en https://doi.org/chs76c
• Hewitt, EJ. 1966. Sand and Water Culture Methods Used in Study of Plant Nutrition (2 ed.). Technical communication of the Commonwealth Bureaux of Horticulture and Plantation Crops. East Malling. Maidstone, Kent. Commonwealth Agricultural Bureaux 547 p.
• Krishna, H; Singh, SK; Patel, VB. 2006. Screening of arbuscular-mycorrhizal fungi for enhanced growth and survival of micropropagated grape (Vitis vinifera) plantlets. Indian Journal of Agricultural Sciences 76(5):297-301.
• Kumar, RK; Singh, KP; Raju, DVS. 2014. Symbiotic Effect of Arbuscular Mycorrhizal Fungi on Growth and Flowering of Micropropagated Plant of Chrysanthemum (Chrysanthemum dendranthemum) (en línea). International Journal of Bio-resource and Stress Management 5(3):369-374. Consultado 13 jul. 2020. Disponible en https://doi.org/gsnm.
• Kumar, A; Singh Meena, V; Roy, P; Vandana; Kumari, R . 201 9. Role of Rhizobia f or Sustainable Agriculture: Lab to Land (en línea). In Kumar, A; Singh Meena, V. Plant Growth Promoting Rhizobacteria for Agricultural Sustainability. From Theory to Practices . pp .12 9-14 9. Consultado 13 jul. 2020. Disponible en https:// doi.org/gsnk
• Liriano G, R; Nuñez, BD; Barceló, R. 2012. Efecto de la aplicación de Rhizobium y Mycorrizas en el crecimiento del frijol (Phaseolus vulgaris L.) variedad CC-25-9 negro. Centro Agrícola 39(4):17-20.
• Lloret, L; Martínez-Romero, E. 2005. Evolución y filogenia de Rhizobium. Review. Revista Latinoamericana de Microbiología 47(1-2):43-60.
• López–Alcocer, JJ; Lépiz-Ildelfonso, R; González- Eguiarte, DR; Rodríguez-Macías, R; López-Alcocer, E; Olalde-Portugal, V. 2017. Caracterización morfológica y bioquímica de cepas de Rhizobium colec- tadas en frijol común silvestre y domesticado (en línea). Revista Fitotecnia Mexicana 40(1):73-81. Consultado 11 may. 2020. Disponible en https:// doi.org/gsm4.
• López-Falcón, R; Espinoza, F. 2015. Degradación del suelo en los llanos de Venezuela (en línea). In López Falcón, R; Hétier, JM; López Hernández, D; Schargel, R (†); Zinck, A. (eds.). Tierras Llaneras de Venezuela... tierras de buena esperanza. Consejo de Publicaciones, Universidad de Los Andes, Mérida, Venezuela. p. 269-301. Consultado 13 feb. 2020. Disponible en https://bit.ly/38gEO2f
• Maiquetía M, MY; Vargas C, TE; Toro G, M; García de G, EC. 2020. Estudios en la germinación y propaga- ción in vitro de tres especies de Leguminosae: Calopogonium sp, Stylosantes capitata y Cassia moschata (en línea). Revista Científica Ecociencia 7(6):1-25. Consultado 16 feb. 2021. Disponible en https://doi.org/gsrp
• Marinho G, GJ; Ndiaye, A; Linhares de A, R; Azevedo E, JA. 2010. Cultivos de coberturas como indicadores de procesos ecológicos (en línea). LEISA. Revista de Agroecología 22(4):20-22. Consultado 13 jul. 2020. Disponible en https://bit.ly/2Y1jhZH
• Martínez-Viera, R; Dibut, B; Ríos, Y. 2010. Reseña “Efecto de la integración de aplicaciones agrícolas de biofertilizantes y fertilizantes minerales sobre las relaciones suelo-planta”. Cultivos Tropicales 31(3):27-31.
• Meng, L; Zhang, A; Wang, F; Han, X; Wang, D; Li, S. 2015. Arbuscular mycorrhizal fungi and rhizobium facilitate nitrogen uptake and transfer in soybean/maize intercropping system (en línea). Frontiers in Plant Science 6(339):1-10. Consultado 11 may. 2020. Disponible en https://doi.org/f7gzzt
• Mirjani, L; Salimi, A; Matinizadeh, M; Razavi, K; Shahbazi, M. 2019. Biotization with Glomus fasciculatum to enhance the acclimatization and absorption of nutrients by micropropagated savory (Satureja khuzistanica Jamzad) plantlets (en línea). Journal of Elementology 24(2):785-802. Consultado 13 jul. 2020. Disponible en https://dx.doi.org/gsm3
• Mora, E; Toro, M; López-Hernández, D. 2013. A survey of arbuscular mycorrhizae, Rhizobium and phosphate solubilizing bacteria in low fertility savanna soils in central Venezuela (Estación Experimental La Iguana). In Miransari, M. (ed). Soil Microbiology. Studium Press LLC, Houston, Texas, USA. p. 97-114.
• Mora, E; Toro, M; López-Hernández, D. 2017. The presence of beneficial organisms associated to N and P economy in the rhizosphere of native vegetation in an oligotrophic savanna of Guárico State, Venezuela (en línea). The Open Plant Science Journal 10:123-133. Consultado 13 jul. 2020. Disponible en https://doi.org/gsm5
• Mora, E; López-Hernández, D; Toro, M. 2019. Arbuscular mycorrhizae and PGPR applications in tropical savannas. In Zúñiga-Dávila, D; González-Andrés, F; Ormeño-Orrillo, E. (eds). Microbial probiotics for agricultural systems. Advances in Agronomic Use. p. 169-177.
• Muthur aj, K ; K af foor, H A ; Nagar ajan, N . 2018 . Establishment of in vitro protocol and impact of mycorrhization with phosphobacteria on micro propagated Pogostemon mollis Benth. (Lamiaceae) (en línea). Journal of Taibah University for Science 12(1):1-10. Consultado 13 jul. 2020. Disponible en https://doi.org/gsng
• Pérez, UA; Ramírez, MM; Zapata, YA; Córdoba, JM. 2015. Efecto de la inoculación simple y combinada con Hongos Formadores de Micorriza Arbuscular (HFMA) y Rizobacterias Promotoras de Crecimiento Vegetal (BPCV) en plántulas micropropagadas de mora (Rubus glaucus L.). Corporación Colombiana de Investigación Agropecuaria 16(1):95-103.
• Pérez, A; Trujillo, I; Vidal, MC; De Lima, N. 2006. Propagación in vitro de Stylosanthes capitata Vogel: Una especie de gran potencial forrajero. Acta Botanica Venezuelica 29(2):335-346.
• Phillips, JM; Hayman, DS. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection (en línea). Transactions of the British Mycological Society 55(1):158-161. Consultado 13 jul 2020. Disponible en https:// doi.org/dnhtg3
• Poole, P; Ramachandran, V; Terpolilli, J. 2018. Rhizobia: from saprophytes to endosymbionts (en línea). Nature Reviews Microbiolog y 16(5):291-303. Consultado 11 may. 2020. Disponible en https:// doi.org/gcwp7s
• Rojas-Rodríguez, F; Torres-Córdoba, G. 2015. Árboles del Valle Central de Costa Rica: reproduc- ción Corralillo (Cassia moschata Kunth) (en línea). Revista Forestal Mesoamericana Kurú 12(29):77-79. Consultado 11 may. 2020. Disponible en https://doi.org/gsnf
• Rupnawar, BS ; Navale, AM; 2000 . Effect of VA - mycorrhizal inoculat ion on grow t h of pomegranate layers. Journal of Maharashtra Agricultural Universities 25(1):44-46.
• Sánchez, S; Hernández, M; Ruz, F. 2011. Alternativas de manejo de la fertilidad del suelo en ecosistemas agropecuarios. Pastos y Forrajes 34(4):375-392.
• Sanabria, B; Silva-Acuña, R; Oliveros, M; Manrique, U. 2004. Germinación de semillas de las leguminosas arbustivas forrajeras Cratylia argentea y Cassia moschata sometidas a inmersión en ácido sulfúrico. Bioagro 16(3):225-230.
• Singh, SK; Minakshi, G; Khawale, RN; Patel, VB; Krishna, H. 2004. Mycorrhization as an aid for biohardening of In vitro raised grape (Vitis vinifera L.) plantlets (en línea). Acta HortIculturae 662(1):289-295. Consultado 11 may. 2020. Disponible en https:// doi.org/gsnd
• Singh, N; Singhb, SK; Singhb, AK; Meshrama, DT; Suroshea, SS; Mishrac, DC; 2012. Arbuscular mycorrhizal fungi (AMF) induced hardening of micropropagated pomegr anate (Punica granatum L .) plantlet s (en línea). Scientia Hor ticulturae 136:122-127. Consultado 13 jul. 2020. Disponible en https://doi.org/gsnb
• Toro, M; Bazo, I; López, M. 2008. Micorrizas arbusculares y bacterias promotoras de crecimiento vegetal, biofertilizantes nativos de sistemas agrícolas bajo manejo conservacionista. Agronomía Tropical 58(3):215-221.
• Toro, M; Andrade, G. 2020. Arbuscular mycorrhizae, beneficial microorganisms for sustainable agricultura (en línea). In Filho W, L; Azul, A; Brandli, L; Lange, S; Wall, T. (eds). Life on land, encyclopedia of the UN sustainable development goals. p. 1-14. Consultado 13 feb. 2021. Disponible en https://doi.org/gsnc
• Toral, O; Machado, R; Navarro, M; Fung, C; Reino, J. 2006. Prospección y colecta de leguminosas multipropósito en la zona central de Cuba. Pastos y Forrajes 29(2):135-143.
• Vidal, MT; Azcón-Aguilar, C; Barea, JM; Pliego-Alfaro, F. 1992. Mycorrhizal Inoculation Enhances Growth and Development of Micropropagated Plant s of Avocado 8en línea). Horticultural Science 27(7):785-787. Consultado 11 may. 2020. Disponible en https://doi.org/gsm9
• Vosátka, M; Jansa, J; Regvar, M; Srámer, F; Malcová, R. 1999. Inoculation with mycorrhizal fungi a feasible biotechnology for horticulture. Phyton 3:219-224.
• Weir, BS. 2016. The current taxonomy of rhizobia. NZ Rhizobia website (en línea). Consultado 10 ago. 2020. Disponible en https://bit.ly/3Be69i8
• Zablowicz, RM; Tipping, EM; Lifshitz, R; Kloepper, JW. 1991. Plant growth promotion mediated by bacterial rhizosphere colonizers (en línea). In Keister, DL; Cregan, PB (eds.). The rhizosphere and plant growth. p. 315-326. Consultado 13 jul. 2020. Disponible en https://doi.org/bd4m66