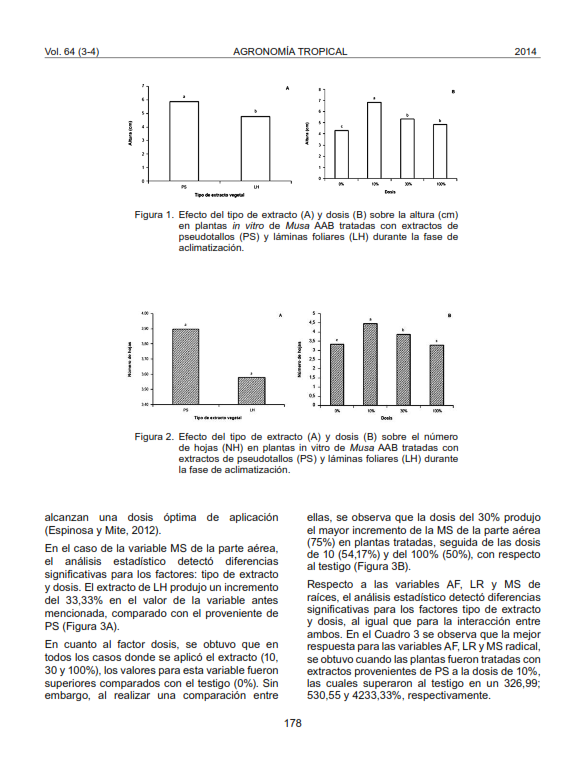
Efecto de diferentes dosis de extractos de plátano sobre el crecimiento de plantas in vitro del mismo cultivo en aclimatización
Resumo
La propagación in vitro es una alternativa para producir semillas sanas de plátano (Musa AAB); no obstante, es necesario mejorar la adaptación de las plantas in vitro a condiciones ex vitro. Para ello, pueden aprovecharse los restos de cosecha del plátano como fuente de extractos promotores del crecimiento en el mismo cultivo, siendo necesario determinar la dosis adecuada que permita las mejores respuestas. Con este fin, se sembraron vitroplantas en recipientes plásticos de 295 ml que contenían tierra, estiércol y concha de arroz en proporción 1:0,5:0,5; bajo un diseño experimental completamente aleatorizado y arreglo factorial 2x4 (tipo de extracto y dosis), con seis repeticiones. Los extractos estudiados fueron: pseudotallos y láminas foliares de plátano en dosis de 0, 10, 30 y 100%. Se evaluó la altura, número de hojas, materia seca de la parte aérea y subterránea, longitud radical, tasa de fotosíntesis neta, transpiración, conductancia estomática y concentración de pigmentos fotosintéticos. Se encontró que la mejor dosis fue la del 10%, independientemente del tipo de extracto, la cual produjo incrementos hasta del 4.233,33%, en las variables evaluadas con respecto al testigo. Se concluye que la dosis de 10% fue suficiente para desencadenar respuestas morfofisiológicas conducentes a mejorar la adaptabilidad de plantas in vitro de plátano en aclimatización. Sin embargo, es recomendable continuar los estudios para clarificar el mecanismo de acción de estos extractos sobre las respuestas morfoanatómicas, fisiológicas y bioquímicas manifestadas por esta especie durante su adaptación a las nuevas condiciones ambientales.
Downloads
Referências
• Agramonte, D., D. Ramírez, M. Pérez, O. Gutiérrez, J. Pérez y M. Núñez. 1998. Manejo integrado de plantas in vitro en la fase de aclimatización. Programa y Resúmenes. XI Seminario Científico del INCA. Cultivos Trop. La Habana. 115 p.
• Albuja, R.; P. Araujo y A. López. 2011. Obtención de un biofertilizante a partir del residuo ultra fino de Spirulina platensis, mediante degradación anaerobia. Boletín Técnico del Departamento de Ciencias de la Vida, Ing. en Biotecnología, Sangolquí, Ecuador. 20 p. Disponible en línea http://bit.ly/38K3DBz [Jun. 22, 2012].
• Aragón, C., M. Escalona, R. Rodríguez, M. Cañal, I. Capote, D. Pina and J. González-Olmedo. 2010. Effect of sucrose, light, and carbon dioxide on plantain micropropagation in temporary immersion bioreactors. In vitro Cell. Dev. Biol. Plant. 46:89-94.
• Arnon, D. I. 1949. Cooper enzymes in insolated chloroplasts. Polyphenoloxidase in Beta vulgaris. Plant Physiology. 24(1):1-15.
• Belalcázar, C., J. Valencia y J. Lozada. 1991. La planta y el fruto. In: Belalcázar, S. (ed). El cultivo del plátano en el trópico. Manual de Asistencia Técnica No. 50. ICA, Armenia, Quindío, INIBAP. Feriva. Cali, Colombia. pp. 45-89.
• Blanco, G. 2014. Respuesta morfofisiológica asociada al mecanismo de acción de extractos vegetales de plátano ‘Hartón’ sobre el crecimiento de plantas in vitro de Musa AAB durante la aclimatización. Tesis Doctoral en Biotecnología Agrícola mención Vegetal. Maracay, Venezuela. Instituto Nacional de Investigaciones Agrícolas (INIA). Escuela Socialista de Agricultura Tropical (ESAT). 117 p.
• Bradford, M. M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of Protein-Dye Binding. Analytical Biochemistry. 72:248-254.
• Calvo, P. y D. Zúñiga. 2010. Caracterización fisiológica de cepas de Bacillus spp. aisladas de la rizósfera de papa (Solanum tuberosum). Ecología Aplicada. 9(1):31-39.
• Espinosa, J. y F. Mite. 2012. Búsqueda de eficiencia en el uso de nutrientes en banano. International Plant Nutrition Institute. Disponible en línea: http://bit.ly/2ID3JjZ [Jun. 22, 2012].
• Garcés, H. 2010. Comparación de la calidad y efectos de lixiviados obtenidos a partir de raquis de banano (Musa acuminata) y plátano (Musa balbisiana) mediante transformación aeróbica y anaeróbica en condiciones de invernadero. Trabajo de grado para la obtención del título de Ingeniero Agropecuario, Escuela Politécnica del Litoral, Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Guayaquil, Ecuador. 133 p.
• Granda, D., A. Mejía y G. Jiménez. 2005.Utilización de residuos de plátano para la producción de metabolitos secundarios por fermentación en estado sólido con el hongo Lentinus crinitus. VITAE. 12(2):13-20.
• Hernández, J. y S. Zamora. 2001. Desarrollo rural sostenible para las zonas productoras de plátano del estado Yaracuy. INIA- Secretaría de Desarrollo Agrícola de la Gobernación del estado Yaracuy. 158 p.
• Hernández, J., A. Cañizares, G. Blanco, I. Arrieche, A. Pérez, C. Salazar y M. González. 2009. Contenido de nitrógeno, fósforo y potasio en harinas de clones de musáceas comestibles (Musa spp.). Revista UDO Agrícola. 9(2):499-457.
• Hiscox, J. y G. Israelstam. 1979. A method for the extraction of chlorophyll from leaf tissue without maceration. National Research Council of Canadá. pp. 1332-1334.
• Idriss, E., O. Makarewicz, A. Farouk, K. Rosner, R. Greiner, H. Bochow, T. Richter and R. Borriss. 2002. Extracellular phytase activity of Bacillus amyloliquefaciens FZB45 contributes to its plant-growth-promoting effect. Microbiology. 148:2097-2109.
• Instituto de Biotecnología de las Plantas de la Universidad Central “Martha Abreu” de Las Villas. 2005. Protocolo para la micropropagación de cultivares de plátano y bananos mediante organogénesis. Cuba.31 p.
• Larco, E. 2004. Desarrollo y evaluación de lixiviados de compost y lombricompost para el manejo de sigatoka negra (Mycosphaerella fijiensis Morelet), en plátano. Tesis de grado Magíster Scientiae. Escuela de Posgraduados, Programa de Educación para el Desarrollo y la Conservación del Centro Agronómico Tropical de Investigación y Enseñanza (CATIE), Costa Rica. 77 p.
• Lezcano, M. 2008. Micropropagación masiva de plantas: El proceso innovador de la Biofábrica. CINNTEC, revista digital de innovación tecnológica. N° 3. Disponible en línea: http://www.cinntec.misiones.gov.ar/index.php?option=com_content&task=view&id=17&Itemid=23. [Abr. 28, 2012].
• Linares, B. 2009. Informe de seguimiento técnico anual del proyecto “Fortalecimiento de cadenas de valor de plátano: Innovaciones tecnológicas para reducir agroquímicos”, caso Venezuela. FONTAGRO-INIA Yaracuy, Venezuela. 10 p.
• Marcano, D. y M. Hasegawa. 2002. Fotoquímica orgánica. Segunda edición. Consejo de Desarrollo Científico y Humanístico. Universidad Central de Venezuela. Editorial Torino. Caracas, Venezuela. 588 p.
• Mazzeo, M., L. León, L. Mejía, L. Guerrero y J.Botero. 2010. Aprovechamiento industrial de residuos de cosecha y poscosecha del plátano en el Departamento de Caldas. Revista Educación e Ingeniería. (9):128-139.
• Murashige, T. and F Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum. 15(3):473-497.
• Norma, Venezolana COVENIN Nº 3276-97.1997. Alimentos. Recuento de Coliformes y de Escherichia coli. Método en placa con películas secas rehidratables (Petrifilm).7 p.
• Norma Venezolana COVENIN Nº 1291-04. 2004. Determinación de Salmonella shigella. Aislamiento e identificación de Salmonella en alimentos. (1a. Revisión). Caracas, Venezuela: Ministerio de Fomento. 35 p.
• Ortiz, M. 2009. Evaluación de la actividad de los lixiviados de raquis de banano (Musa AAA), plátano (Musa AAB) y banano Orito (Musa AA) sobre el agente causal de la sigatoka negra (Mycosphaerella fijiensis Morelet) en condiciones in vitro. Trabajo de grado Ingeniera Agropecuaria. Facultad de Ingeniería en Mecánica y Ciencias de la Producción. Escuela Politécnica del Litoral. Guayaquil, Ecuador. 110 p.
• Russo, R., J. Lugo, O. Arreola y O. Arango.1995. Efecto de un bioestimulante húmico extraído del raquis de banano (pinzote) sobre el crecimiento de plántulas de banano (Musa AAB subgrupo Cavendish clon Gran enano). Agronomía Mesoamericana. 6:130-133.
• Stalikas, C. 2007. Extraction, separation and detection methods for phenolic acids and flavonoids. V. Sep. Sci. 30:3268-3295.
• Walkley, A. and I. A. Black. 1934. An Examination of Degtjareff Method for Determining Soil Organic Matter and a Proposed Modification of the Chromic Acid Titration Method. Soil Sci. 37:29-37.